Lehrstuhl für Regenerative Medizin kardiovaskulärer Erkrankungen
(English: Regenerative Medicine of Cardiovascular Diseases)
Jüngste Fortschritte in der Entwicklungs- und Stammzellbiologie haben den Weg für ein breites Spektrum neuartiger kardiovaskulärer Therapien geebnet, von der Transplantation von aus Stammzellen gewonnenen Zellen bis hin zur Stimulierung körpereigener Regenerationsprozesse. Es sind jedoch noch viele grundlegende wissenschaftliche Fragen zu beantworten, bevor diese Konzepte erfolgreich in die Behandlung von Patienten umgesetzt werden können. Die Beantwortung solcher Fragen mit State-of-the-art Methoden ist das übergreifende Ziel unserer Arbeitsgruppe.
In den nachfolgend beschriebenen Forschungsprojekten kombinieren wir 2D- und 3D-In-vitro-Modelle, die auf menschlichen pluripotenten Stammzellen basieren, mit Tiermodellen wie der Maus und dem Schwein. Ein weiterer wichtiger Aspekt unserer Arbeit ist der Einsatz von CRISPR/Cas9-Gen-Editierung für viele Anwendungen, einschließlich der Erzeugung von Reporterzelllinien und der Entwicklung neuer Gentherapieansätze.
Forschungsgebiete
Das Herz ist das erste Organ, das sich bildet, und weist eine komplexe Struktur auf, die aus vielen spezialisierten Zelltypen besteht (z. B. Herzmuskelzellen, Zellen der Blutgefäße und Bindegewebszellen). Während der Entwicklung müssen sich Zellen schnell vermehren, aber auch spezifizieren, d. h. ihr Entwicklungspotenzial begrenzen und festlegen, in welchen Zelltyp sie sich später differenzieren werden. Unsere Forschungsgruppe untersucht, wie verschiedene kardiovaskuläre Vorläuferpopulationen entstehen, sich spezifizieren und differenzieren. Dies verfolgen wir insbesondere durch die Rekonstruktion von Abstammungslinien mittels Einzelzell-Transkriptomik und der Analyse von Chromatinzugänglichkeit. Wir sind außerdem daran interessiert, wie diese Prozesse bei angeborenen Herzfehlern gestört werden und wie wir das Wissen aus der Entwicklung nutzen können, um neue regenerative Ansätze für Erwachsene zu entwickeln.
Eines unserer Interessensgebiete ist die Funktion von frühen kardialen Transkriptionsfaktoren wie Isl1. Jener wird in kardiovaskulären Vorläuferzellen des sogenannten zweiten Herzfeldes (SHF) exprimiert, die später hauptsächlich zur Bildung der rechten Herzkammer, des Ausflusstraktes und Teilen der Vorhöfe beitragen.
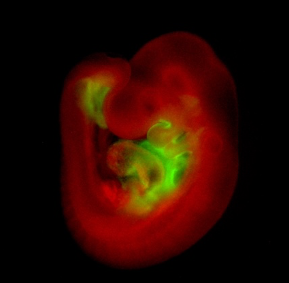
Whole-mount immunhistologische Färbung eines Isl1Cre/+;R26mTmG/+-Embryos am Embryonaltag 9,5. Sie zeigt die Isl1-Cre-vermittelte mG-Markierung (grün) von Vorläufern des SHF und ihrer Derivate.
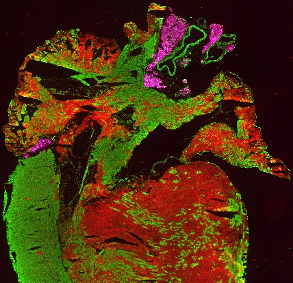
Immunhistologische Färbung eines Herzschnitts einer Isl1Cre/+;R26mTmG/+ Maus im Alter von 4 Wochen, die Isl1-Cre-vermittelte mG-Markierung (grün) der rechten Herzkammer, von Teilen der linken Herzkammer und beider Vorhöfe zeigt. Perilipin1 (magenta) markiert Adipozyten.
Humane induzierte pluripotente Stammzellen (hiPSCs) sind Stammzellen, die aus somatischen Zellen (z. B. Blut- oder Hautzellen) von gesunden Personen oder Patienten gewonnen werden. Sie haben die Fähigkeit, sich unbegrenzt zu erneuern und in vitro jeden Zelltyp des Körpers hervorzubringen, was sie zu einem außerordentlich leistungsfähigen Instrument für die Untersuchung menschlicher Krankheiten auf patientenspezifischem Hintergrund macht. Ein Schwerpunkt unserer Forschung ist der Einsatz von hiPSC-basierten Krankheitsmodellen zur Gewinnung von Einblicken in die molekularen und zellulären Mechanismen, die zu Herz-Kreislauf-Erkrankungen wie der arrhythmogenen rechtsventrikulären Kardiomyopathie (ARVC), dem hypoplastischen Linksherzsyndrom (HLHS), der mit dem Noonan-Syndrom assoziierten Kardiomyopathie, der linksventrikulären Non-compaction (LVNC) und anderen führen. Wenn ein therapeutisches Ziel identifiziert ist, verwenden wir hiPSC-Zellen auch als Plattform für die Erprobung neuer Therapien, wie wir dies bereits bei der Duchenne-Muskeldystrophie (DMD) angewandt haben.
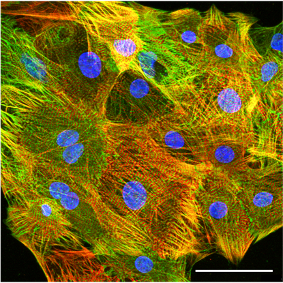
Konfokales Immunfluoreszenzbild von hiPSC-abgeleiteten Kardiomyozyten, gefärbt für die Sarkomerproteine cardiac troponin T (rot) und a-actinin (grün). Skalenbalken: 50 µm.

Live-Immunfluoreszenzbild eines 3D-Herzsphäroids, das aus einer Doppelreporter-Stammzelllinie stammt, die eGFP und mCherry in den endogenen Loci der kardialen Transkriptionsfaktoren NKX2.5 bzw. TBX5 exprimiert. Skalenbalken: 200 µm.
Da Zellen, die in 2D kultiviert werden, bestimmte Eigenschaften ihrer in vivo-Gegenstücke nicht nachbilden können, ist ein Teil unserer Arbeit der Entwicklung von 3D-Herzmodellen gewidmet, die die Physiologie des Herzgewebes besser nachahmen. Wir stellen routinemäßig künstliches Herzgewebe auf der Grundlage von hiPSC-Herzzellen her, die auf dezellularisierte ventrikuläre Matrix von Schweinen oder nichtmenschlichen Primaten ausgesät wurden. Diese Konstrukte kultivieren wir in einem biomimetischen Kammersystem, das die Gewebereifung durch kontinuierliche mechanische und elektrische Stimulation fördert. Wir haben auch ein Ex-vivo-Embryo-Kultursystem entwickelt, mit dem wir die Funktion menschlicher Herzzellen in Mensch-Maus- oder Mensch-Schwein-Chimären untersuchen können. Schließlich haben wir vor kurzem aus menschlichen pluripotenten Stammzellen abgeleitete Herzorganoide erzeugt, die eine morphologische, funktionelle und molekulare Selbstorganisation des ventrikulären Myokards und Epikards aufweisen.
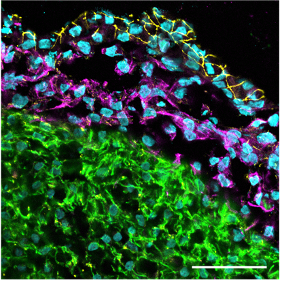
Konfokales Immunfluoreszenzbild eines kardialen Organoidschnitts, das die äußere Epikardschicht (tight junction protein 1 Färbung in gelb), die darunter liegenden EPDCs, die eine epithelial-mesenchymale Transition durchlaufen haben (Vimentin Färbung in magenta), und die Myokardschicht (cardiac troponin T Färbung in grün) zeigt. Skalenbalken: 50 µm.
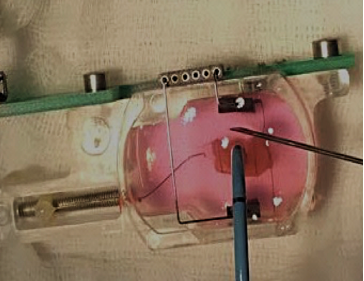
Biomimetische Kammer mit künstlichem Herzgewebe, das einer Hochfrequenzablation unterzogen wird, um eine akute Herzmuskelverletzung zu simulieren.
- Erzeugung, Kultivierung und Differenzierung humaner pluripotenter Stammzellen in 2D und 3D
- CRISPR/Cas9 Gen-Editierung für die Erzeugung von Reporterlinien und Knock-in/Knock-out-Linien
- Funktionelle Charakterisierung von Kardiomyozyten durch Kalzium-Imaging, optische Ableitungen des Aktionspotenzials und Kontraktilitätsmessungen
- Bulk- und single-cell-RNA-sequencing und ATAC-sequencing
- Immunofluoreszenzanalyse, konfokale Mikroskopie
- Durchflusszytometrie und FACS sorting
- Zellinjektion in Embryonen und ex vivo Embryokultivierung
- Molekularbiologische Techniken einschließlich Klonierung, digitale PCR
- Kapillarer Western Blot, Chromatin-Immunpräzipitation
Prof. Dr. Alessandra Moretti
Chair of Regenerative Medicine of Cardiovascular Diseases, group leaderDr. Tatjana Dorn
Senior scientist (developmental biology, lineage decision)Dr. Monika Nowak-Imialek
Veterinarian scientist (porcine expanded pluripotent stem cells & human-pig chimeras)Dr. Gianluca Santamaria
Postdoc (bioinformatic data analysis)Dr. Alexander Göedel
Physician scientist (bioinformatic data analysis)Dr. Christine Schneider
Physician scientist (3D tissue engineering & functional imaging)Sophie Zengerle
PhD student (organoids and modeling of congenital heart disease)Sinem Sürmeli
PhD student (CRISPR-based genome editing)Luis Felipe Monge Mora
PhD student (cardiac organiods and imaging)Marco Crovella
Technician (animals and histology)Christina Scherb
Technician (molecular biology)Birgit Campbell
Technician (cell culture and iPSC generation)Aylin Mayer
Technician (heart tissue slices and gene editing)
Originalarbeiten
Rawat H, Kornherr J, Zawada D, Bakhshiyeva S, Kupatt C, Laugwitz KL, Bähr A, Dorn T, Moretti A, Nowak-Imialek M. (2023) Recapitulating porcine cardiac development in vitro: from expanded potential stem cell to embryo culture models. Front Cell Dev Biol. 11:1111684. doi: 10.3389/fcell.2023.1111684. PMID: 37261075
Poch CM, Dendorfer A, Laugwitz KL, Moretti A. (2023) Ex vivo Culture and Contractile Force Measurements of Non-human Primate Heart Slices. Bio Protoc. 13(13):e4750. doi: 10.21769/BioProtoc.4750. PMID: 37456341
Meier AB, Zawada D, De Angelis MT, Martens LD, Santamaria G, Zengerle S, Nowak-Imialek M, Kornherr J, Zhang F, Tian Q, Wolf CM, Kupatt C, Sahara M, Lipp P, Theis FJ, Gagneur J, Goedel A, Laugwitz KL, Dorn T, Moretti A. (2023) Epicardioid single-cell genomics uncovers principles of human epicardium biology in heart development and disease. Nat Biotechnol. 41(12):1787-1800. doi: 10.1038/s41587-023-01718-7. PMID: 37012447
Zawada D, Kornherr J, Meier AB, Santamaria G, Dorn T, Nowak-Imialek M, Ortmann D, Zhang F, Lachmann M, Dreßen M, Ortiz M, Mascetti VL, Harmer SC, Nobles M, Tinker A, De Angelis MT, Pedersen RA, Grote P, Laugwitz KL, Moretti A, Goedel A. (2023) Retinoic acid signaling modulation guides in vitro specification of human heart field-specific progenitor pools. Nat Commun. 14(1):1722. doi: 10.1038/s41467-023-36764-x. PMID: 37012244
Poch CM, Foo KS, De Angelis MT, Jennbacken K, Santamaria G, Bähr A, Wang QD, Reiter F, Hornaschewitz N, Zawada D, Bozoglu T, My I, Meier A, Dorn T, Hege S, Lehtinen ML, Tsoi YL, Hovdal D, Hyllner J, Schwarz S, Sudhop S, Jurisch V, Sini M, Fellows MD, Cummings M, Clarke J, Baptista R, Eroglu E, Wolf E, Klymiuk N, Lu K, Tomasi R, Dendorfer A, Gaspari M, Parrotta E, Cuda G, Krane M, Sinnecker D, Hoppmann P, Kupatt C, Fritsche-Danielson R, Moretti A, Chien KR, Laugwitz KL. (2022) Migratory and anti-fibrotic programmes define the regenerative potential of human cardiac progenitors. Nat Cell Biol. 24(5):659-671. doi: 10.1038/s41556-022-00899-8. PMID: 35550611
Esfandyari D, Idrissou BMG, Hennis K, Avramopoulos P, Dueck A, El-Battrawy I, Grüter L, Meier MA, Näger AC, Ramanujam D, Dorn T, Meitinger T, Hagl C, Milting H, Borggrefe M, Fenske S, Biel M, Dendorfer A, Sassi Y, Moretti A, Engelhardt S. (2022) MicroRNA-365 regulates human cardiac action potential duration. Nat Commun. 13(1):220. doi: 10.1038/s41467-021-27856-7. PMID: 35017523
Krane M, Dreßen M, Santamaria G, My I, Schneider CM, Dorn T, Laue S, Mastantuono E, Berutti R, Rawat H, Gilsbach R, Schneider P, Lahm H, Schwarz S, Doppler SA, Paige S, Puluca N, Doll S, Neb I, Brade T, Zhang Z, Abou-Ajram C, Northoff B, Holdt LM, Sudhop S, Sahara M, Goedel A, Dendorfer A, Tjong FVY, Rijlaarsdam ME, Cleuziou J, Lang N, Kupatt C, Bezzina C, Lange R, Bowles NE, Mann M, Gelb BD, Crotti L, Hein L, Meitinger T, Wu S, Sinnecker D, Gruber PJ, Laugwitz KL, Moretti A. (2021) Sequential Defects in Cardiac Lineage Commitment and Maturation Cause Hypoplastic Left Heart Syndrome. Circulation. 144(17):1409-1428. doi: 10.1161/CIRCULATIONAHA.121.056198. PMID: 34694888
Buchkapitel, Reviews und Editorials
Wissenschaftliche Projekte:
Naturwissenschaftliche Diplom- und Doktorarbeiten sowie medizinische Doktorarbeiten auf Anfrage
Drittmittelförderung:
- European Research Council - EPICURE
- Deutsche Forschungsgemeinschaft
- Deutsches Zentrum für Herz-/Kreislaufforschung, Munich Heart
Alliance
- Else Kröner-Fresenius-Stiftung




