Molekulare Intervention
Die Arbeitsgruppe Molekulare Interventionen ist an therapeutischen Ansätzen in molekularen Signalwegen von Herz-Kreislauferkrankungen interessiert. Dabei wird ein weites Spektrum von kardiologischen Krankheiten, wie Ischämie/ Reperfusion, chronische-ischämische Kardiomyopathie, Herzhypertrophie und genetische Kardiomyopathien, u.a. in Großtieren abgedeckt. Als Vehikel für das Eingreifen in pathologische Signalwege werden neben pharmakologischen Agentien auch AAV-Viren verwendet, die das Arbeitsmyokard effizient und langanhaltend bei geringer Aktivierung des Immunsystems transduzieren können.
Forschungsgebiete
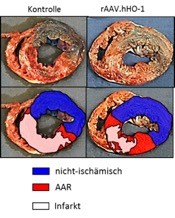
Abbildung: Infarktgröße nach Revaskularisierung und protektiver Therapie
Neben dem akuten Myokardinfarkt ist die chronische Durchblutungsstörung, verursacht durch ein allmähliches Verschließen einer Koronararterie, Ursache ischämischer Kardiomyopathien. Sind interventionelle und herzchirurgische Methoden zur Revaskularisierung der großen Herzkranzgefäße erschöpft, bietet sich hier die Option der molekularen Intervention zur Induktion von neuen Gefäßen im Bereich der Makro-Gefäße (Arteriogenese) und Mikrozirkulation (Angiogenese, Arteriologenese). Unser Labor hat in den letzten 10 Jahren Vektoren und Faktoren für das biologische Gefäßwachstum verbessert und im Großtiermodell erfolgreich eingesetzt. Selbst bei vorhandenen kardiovaskulären Risikofaktoren, wie erhöhten Blutfetten und Diabetes mellitus, lässt sich mit aktuellen molekularen Signalen ein solches Gefäßwachstum herbeiführen und eine deutliche Verbesserung der Durchblutung von chronisch minderdurchblutetem Myokard erzielen.
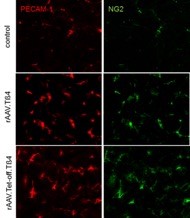
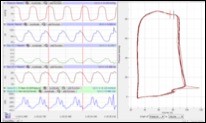
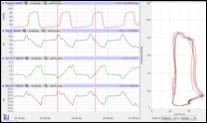
Abbildung: Neubildung von Blutgefäßen und deren Maturierung mittels Perizytenanlagerung
From: Nat Commun. 2014 Jun 9;5:3970. doi: 10.1038/ncomms4970.Herzhypertrophie
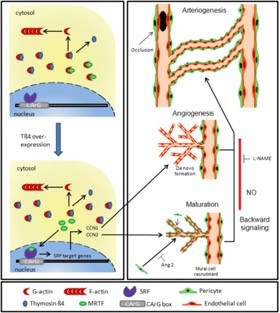
Abbildung: Mindestanforderungen für eine therapeutische Neovaskularisierung am Beispiel von Thymosin ß4
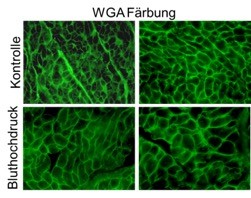
Abbildung: Blutdruck-induzierte Herzhypertrophie und Kontrolle
Verschiedene Großtiermodelle für kardiovaskuläre Erkrankungen und die relevanten Risikogruppen (Diabetes, Hyperlipidämie) wurden für die präklinische Erforschung neuartiger Therapien etabliert. Hierzu zählen u. a. das Infarktmodell (i. F. induzierter Ischämie und Reperfusion), das hibernierende Myokardmodell für die chronische Ischämie, das Hypertrophie-Modell (i. F. transverser Aortenkonstriktion) und das Duchenne-Muskeldystrophie-Modell (kongenitale Herzerkrankung).
Prof. Dr. med. Christian Kupatt-Jeremias
Group leaderDr. Andrea Bähr
Veterinary scientist (Leader of the large animal team)Dr. Tarik Bozoglu
Senior scientist (molecular biology, AAV design)Dr. Vijayanand Rajendran
Senior scientist (molecular biology, AAV design)Dr. Tilman Ziegler
Physician scientist (mice studies, angiogenetic biomolecules)Dr. Ruth Thalmann
Physician scientist (clinical studies, TAVI)Dr. Anja Stundl
Physician scientist (clinical studies, TAVI)Dr. Nour Raad
Physician scientist (modelling of electrophysiological mapping)Dr. Xinghai Li
Physician scientist (large animal interventions)Anja Wolf
Technical assistant (cell culture, AAV production, lab manager)Ina Marie Luksch
PhD student (molecular biology, AAV design)Samihana Shrestha
Veterinary doctoral student (large animal interventions)Mara Leonie Corsten
Veterinary doctoral student (large animal interventions)
Immature human engineered heart tissues engraft in a guinea pig chronic injury model. von Bibra C, Shibamiya A, Bähr A, Geertz B, Köhne M, Stuedemann T, Starbatty J, Horneffer-van der Sluis V, Klostermeier UC, Hornaschewitz N, Li X, Wolf E, Klymiuk N, Krane M, Kupatt C, Hiebl B, Eschenhagen T, Weinberger F. Dis Model Mech. 2023 May 1;16(5):dmm049834. doi: 10.1242/dmm.049834.
Epicardioid single-cell genomics uncovers principles of human epicardium biology in heart development and disease. Meier AB, Zawada D, De Angelis MT, Martens LD, Santamaria G, Zengerle S, Nowak-Imialek M, Kornherr J, Zhang F, Tian Q, Wolf CM, Kupatt C, Sahara M, Lipp P, Theis FJ, Gagneur J, Goedel A, Laugwitz KL, Dorn T, Moretti A. Nat Biotechnol. 2023 Apr 3. doi: 10.1038/s41587-023-01718-7.
Thymosin ß4 and MRTF-A mitigate vessel regression despite cardiovascular risk factors. Kupatt C, Ziegler T, Bähr A, Le Noble F. Int Immunopharmacol. 2023 Apr;117:109786. doi: 10.1016/j.intimp.2023.109786.
Prognostic impact of high-sensitive troponin on 30-day mortality in patients with acute heart failure and different classes of left ventricular ejection fraction. Ledwoch J, Kraxenberger J, Krauth A, Schneider A, Leidgschwendner K, Schneider V, Müller A, Laugwitz KL, Kupatt C, Martens E. Heart Vessels. 2022 Jul;37(7):1195-1202. doi: 10.1007/s00380-022-02026-x.
Migratory and anti-fibrotic programmes define the regenerative potential of human cardiac progenitors. Poch CM, Foo KS, De Angelis MT, Jennbacken K, Santamaria G, Bähr A, Wang QD, Reiter F, Hornaschewitz N, Zawada D, Bozoglu T, My I, Meier A, Dorn T, Hege S, Lehtinen ML, Tsoi YL, Hovdal D, Hyllner J, Schwarz S, Sudhop S, Jurisch V, Sini M, Fellows MD, Cummings M, Clarke J, Baptista R, Eroglu E, Wolf E, Klymiuk N, Lu K, Tomasi R, Dendorfer A, Gaspari M, Parrotta E, Cuda G, Krane M, Sinnecker D, Hoppmann P, Kupatt C, Fritsche-Danielson R, Moretti A, Chien KR, Laugwitz KL. Nat Cell Biol. 2022 May;24(5):659-671. doi: 10.1038/s41556-022-00899-8.
Harnessing feature extraction capacities from a pre-trained convolutional neural network (VGG-16) for the unsupervised distinction of aortic outflow velocity profiles in patients with severe aortic stenosis. Lachmann M, Rippen E, Rueckert D, Schuster T, Xhepa E, von Scheidt M, Pellegrini C, Trenkwalder T, Rheude T, Stundl A, Thalmann R, Harmsen G, Yuasa S, Schunkert H, Kastrati A, Joner M, Kupatt C, Laugwitz KL. Eur Heart J Digit Health. 2022 Apr 22;3(2):153-168. doi: 10.1093/ehjdh/ztac004.
Interdependence of Angiogenesis and Arteriogenesis in Development and Disease. le Noble F, Kupatt C. Int J Mol Sci. 2022 Mar 31;23(7):3879. doi: 10.3390/ijms23073879.
Diagnostic Accuracy of High-Sensitive Troponin for the Identification of Myocardial Infarction in Patients Presenting with Acute Heart Failure. Ledwoch J, Schneider A, Leidgschwendner K, Kraxenberger J, Krauth A, Schneider V, Martens E, Müller A, Laugwitz KL, Kupatt C. J Emerg Med. 2022 Mar;62(3):359-367. doi: 10.1016/j.jemermed.2021.11.013.
Endothelial Retargeting of AAV9 In Vivo. Bozoglu T, Lee S, Ziegler T, Jurisch V, Maas S, Baehr A, Hinkel R, Hoenig A, Hariharan A, Kim CI, Decker S, Sami H, Koppara T, Oellinger R, Müller OJ, Frank D, Megens R, Nelson P, Weber C, Schnieke A, Sperandio M, Santamaria G, Rad R, Moretti A, Laugwitz KL, Soehnlein O, Ogris M, Kupatt C. Adv Sci (Weinh). 2022 Mar;9(7):e2103867. doi: 10.1002/advs.202103867.
Somatic gene editing ameliorates skeletal and cardiac muscle failure in pig and human models of Duchenne muscular dystrophy. Moretti A, Fonteyne L, Giesert F, Hoppmann P, Meier AB, Bozoglu T, Baehr A, Schneider CM, Sinnecker D, Klett K, Fröhlich T, Rahman FA, Haufe T, Sun S, Jurisch V, Kessler B, Hinkel R, Dirschinger R, Martens E, Jilek C, Graf A, Krebs S, Santamaria G, Kurome M, Zakhartchenko V, Campbell B, Voelse K, Wolf A, Ziegler T, Reichert S, Lee S, Flenkenthaler F, Dorn T, Jeremias I, Blum H, Dendorfer A, Schnieke A, Krause S, Walter MC, Klymiuk N, Laugwitz KL, Wolf E, Wurst W, Kupatt C. Nat Med. 2020 Feb;26(2):207-214. doi: 10.1038/s41591-019-0738-2.
Consistent success in life-supporting cardiac xenotransplantation. Längin M, Mayr T, Reichart B, Michel S, Buchholz S, Guethoff S, Dashkevich A, Baehr A, Egerer S, Bauer A, Mihalj M, Panelli A, Issl L, Ying J, Fresch AK, Buttgereit I, Mokelke M, Radan J, Werner F, Lutzmann I, Steen S, Sjöberg T, Paskevicius A, Qiuming L, Sfriso R, Rieben R, Dahlhoff M, Kessler B, Kemter E, Klett K, Hinkel R, Kupatt C, Falkenau A, Reu S, Ellgass R, Herzog R, Binder U, Wich G, Skerra A, Ayares D, Kind A, Schönmann U, Kaup FJ, Hagl C, Wolf E, Klymiuk N, Brenner P, Abicht JM. Nature. 2018 Dec;564(7736):430-433. doi: 10.1038/s41586-018-0765-z.
Early weaning completely eliminates porcine cytomegalovirus from a newly established pig donor facility for xenotransplantation. Egerer S, Fiebig U, Kessler B, Zakhartchenko V, Kurome M, Reichart B, Kupatt C, Klymiuk N, Wolf E, Denner J, Bähr A, Xenotransplantation 2018; 25: e12449. doi: 10.1111/xen.12449.
Interplay of cell-cell contacts and RhoA/MRTF-A signaling regulates cardiomyoycyte identity. Dorn T, Kornherr J, Parrotta EI, Zawada D, Ayetey H, Santamaria G, Iop L, Mastantuono E, Sinnecker D, Goedel A, Dirschinger RJ, My I, Laue S, Bozoglu T, Baarlink C, Ziegler T, Graf E, Hinkel R, Cuda G, Kääb S, Grace AA, Grosse R, Kupatt C, Meitinger T, Smith AG, Laugwitz KL, Moretti A., EMBO J 2018; 37: e98133. doi: 10.15252/embj.201798133.
Tβ4 Increases Neovascularization and Cardiac Function in Chronic Myocardial Ischemia of Normo- and Hypercholesterolemic Pigs. Ziegler T, Bähr A, Howe A, Klett K, Husada W, Weber C, Laugwitz KL, Kupatt C, Hinkel R. Mol Ther 2018; 26: 1706-1714. doi: 10.1016/j.ymthe.2018.06.004
Diabetes Mellitus-Induced Microvascular Destabilization in the Myocardium. Hinkel R, Hoewe A, Renner S, Ng J, Lee S, Klett K, Kaczmarek V, Moretti A, Laugwitz KL, Skroblin P, Mayr M, Milting H, Dendorfer A, Reichart B, Wolf E, Kupatt C. J Am Coll Cardiol. 2017 Jan 17;69(2):131-143. doi: 10.1016/j.jacc.2016.10.058.
Thymosin-β4-mediated therapeutic neovascularization: role of the PI3K/AKT pathway. Trenkwalder T, Deindl E, Bongiovanni D, Lee S, Schunkert H, Kupatt C, Hinkel R. Expert Opin Biol Ther. 2015 Feb 4:1-11. doi: 10.1517/14712598.2015.1011122
Thymosin β4 attenuates microcirculatory and hemodynamic destabilization in sepsis. Bongiovanni D, Ziegler T, D'Almeida S, Zhang T, Ng JK, Dietzel S, Hinkel R, Kupatt C. Expert Opin Biol Ther. 2015 Jan 21:1-8. doi: 10.1517/14712598.2015.1006193
Adeno-associated viral vector 2.9 thymosin ß4 application attenuates rejection after heart transplantation: results of a preclinical study in the pig. Postrach J, Schmidt M, Thormann M, Thein E, Burdorf L, Reichart B, Sotlar K, Walz C, Faber C, Bauer A, Schmoeckel M, Kupatt C, Hinkel R. Transplantation. 2014 Oct 27;98(8):835-43. doi: 10.1097/TP.0000000000000327.
Targeting microRNAs for cardiovascular therapeutics in coronary artery disease. Hinkel R, Ng JK, Kupatt C. Curr Opin Cardiol. 2014 Nov;29(6):586-94. doi: 10.1097/HCO.0000000000000107.
MRTF-A controls vessel growth and maturation by increasing the expression of CCN1 and CCN2. Hinkel R, Trenkwalder T, Petersen B, Husada W, Gesenhues F, Lee S, Hannappel E, Bock-Marquette I, Theisen D, Leitner L, Boekstegers P, Cierniewski C, Müller OJ, le Noble F, Adams RH, Weinl C, Nordheim A, Reichart B, Weber C, Olson E, Posern G, Deindl E, Niemann H, Kupatt C. Nat Commun. 2014 Jun 9;5:3970. doi: 10.1038/ncomms4970.
VEGF-B: a more balanced approach toward cardiac neovascularization? Kupatt C, Hinkel R. EMBO Mol Med. 2014 Mar;6(3):297-8. doi: 10.1002/emmm.201303730.
Transcutaneous aortic valve replacement with the Edwards SAPIEN XT and Medtronic CoreValve prosthesis under fluoroscopic guidance and local anaesthesia only. Greif M, Lange P, Näbauer M, Schwarz F, Becker C, Schmitz C, Pohl T, D'Anastasi M, Boekstegers P, Massberg S, Kupatt C. Heart. 2014 May;100(9):691-5. doi: 10.1136/heartjnl-2013-304918.
Edwards Sapien XT valve placement as treatment option for aortic regurgitation after transfemoral CoreValve implantation: a multicenter experience. Diemert P, Lange P, Greif M, Seiffert M, Conradi L, Massberg S, Blankenberg S, Reichenspurner H, Hagl C, Schmitz C, Schröfel H, Treede H, Schymik G, Kupatt C. Clin Res Cardiol. 2014 Mar;103(3):183-90. doi: 10.1007/s00392-013-0632-8.
Inhibition of microRNA-92a protects against ischemia/reperfusion injury in a large-animal model. Hinkel R, Penzkofer D, Zühlke S, Fischer A, Husada W, Xu QF, Baloch E, van Rooij E, Zeiher AM, Kupatt C, Dimmeler S. Circulation. 2013 Sep 3;128(10):1066-75. doi: 10.1161/CIRCULATIONAHA.113.001904.
Angiopoietin 2 mediates microvascular and hemodynamic alterations in sepsis. Ziegler T, Horstkotte J, Schwab C, Pfetsch V, Weinmann K, Dietzel S, Rohwedder I, Hinkel R, Gross L, Lee S, Hu J, Soehnlein O, Franz WM, Sperandio M, Pohl U, Thomas M, Weber C, Augustin HG, Fässler R, Deutsch U, Kupatt C. J Clin Invest. 2013 Jul 1. pii: 66549. doi: 10.1172/JCI66549.
Balloon valvuloplasty for treatment of cardiogenic shock in the era of surgical valve replacement and TAVI. Theiss HD, Greif M, Steinbeck G, Kupatt C, Franz WM. Intern Emerg Med. 2014 Apr;9(3):345-7. doi: 10.1007/s11739-013-0972-4.
SDF-1 fused to a fractalkine stalk and a GPI anchor enables functional neovascularization. Stachel G, Trenkwalder T, Götz F, El Aouni C, Muenchmeier N, Pfosser A, Nussbaum C, Sperandio M, Hatzopoulos AK, Hinkel R, Nelson PJ, Kupatt C. Stem Cells. 2013 Sep;31(9):1795-805. doi: 10.1002/stem.1439.
Transfemoral access for valve in valve implantation of an Edwards Sapien XT valve in a stenotic tricuspid bioprosthesis under fluoroscopic guidance. Greif M, Schramm R, Steinbeck G, Hagl C, Schmitz C, Kupatt C. Can J Cardiol. 2013 Aug;29(8):1014.e3-4. doi: 10.1016/j.cjca.2012.11.027. Epub 2013 Feb 11.
Angiogenetic potential of Ad2/Hif-1α/VP16 after regional application in a preclinical pig model of chronic ischemia. Hinkel R, Lebherz C, Fydanaki M, Wuchrer A, El-Aouni C, Thormann M, Thein E, Kupatt C, Boekstegers P. Curr Vasc Pharmacol. 2013 Jan;11(1):29-37.
Transcatheter aortic-valve endocarditis confirmed by transesophageal echocardiography. Orban M, Sinnecker D, Mair H, Nabauer M, Kupatt C, Schmitz C, Massberg S, Laugwitz KL, Barthel P. Circulation. 2013 Jan 15;127(2):e265-6. doi: 10.1161/CIRCULATIONAHA.112.109033.
Molecular and cellular mechanisms of thymosin β4-mediated cardioprotection. Hinkel R, Trenkwalder T, Kupatt C. Ann N Y Acad Sci. 2012 Oct;1269:102-9. doi: 10.1111/j.1749-6632.2012.06693.x.
Transcatheter Edwards Sapien XT valve in valve implantation in degenerated aortic bioprostheses via transfemoral access. Greif M, Lange P, Mair H, Becker C, Schmitz C, Steinbeck G, Kupatt C. Clin Res Cardiol. 2012 Dec;101(12):993-1001. doi: 10.1007/s00392-012-0488-3.
Adjuvant early and late cardioprotective therapy: access to the heart. Hinkel R, Boekstegers P, Kupatt C. Cardiovasc Res. 2012 May 1;94(2):226-36. doi: 10.1093/cvr/cvs075.
Mitochondrial thioredoxin reductase is essential for early postischemic myocardial protection. Horstkotte J, Perisic T, Schneider M, Lange P, Schroeder M, Kiermayer C, Hinkel R, Ziegler T, Mandal PK, David R, Schulz S, Schmitt S, Widder J, Sinowatz F, Becker BF, Bauersachs J, Naebauer M, Franz WM, Jeremias I, Brielmeier M, Zischka H, Conrad M, Kupatt C. Circulation. 2011 Dec 20;124(25):2892-902. doi: 10.1161/CIRCULATIONAHA.111.059253.
Gene therapy for ischemic heart disease. Hinkel R, Trenkwalder T, Kupatt C. Expert Opin Biol Ther. 2011 Jun;11(6):723-37. doi: 10.1517/14712598.2011.570749.
Cotransfection of vascular endothelial growth factor-A and platelet-derived growth factor-B via recombinant adeno-associated virus resolves chronic ischemic malperfusion role of vessel maturation. Kupatt C, Hinkel R, Pfosser A, El-Aouni C, Wuchrer A, Fritz A, Globisch F, Thormann M, Horstkotte J, Lebherz C, Thein E, Banfi A, Boekstegers P. J Am Coll Cardiol. 2010 Jul 27;56(5):414-22. doi: 10.1016/j.jacc.2010.03.050.
Thymosin beta4: a key factor for protective effects of eEPCs in acute and chronic ischemia. Hinkel R, Bock-Marquette I, Hatzopoulos AK, Kupatt C. Ann N Y Acad Sci. 2010 Apr;1194:105-11. doi: 10.1111/j.1749-6632.2010.05489.x.
Nonviral intercellular adhesion molecule-1 small interfering ribonucleic acid sequences transfection in vivo how ultrasound bursts into therapy. Kupatt C. J Am Coll Cardiol. 2010 Mar 2;55(9):914-6. doi: 10.1016/j.jacc.2009.10.036.
Partial avulsion of prosthetic aortic valve caused by S. epidermidis infection resulting in a giant false aneurysm of the complete thoracic aorta. Brunner S, Kriegl L, Becker C, Kreuzer E, Reichart B, Näbauer M, Steinbeck G, Kupatt C. Int J Cardiol. 2011 Aug 4;150(3):e89-91. doi: 10.1016/j.ijcard.2009.11.029. Epub 2010 Jan 6.
Transgenic expression of the human A20 gene in cloned pigs provides protection against apoptotic and inflammatory stimuli. Oropeza M, Petersen B, Carnwath JW, Lucas-Hahn A, Lemme E, Hassel P, Herrmann D, Barg-Kues B, Holler S, Queisser AL, Schwinzer R, Hinkel R, Kupatt C, Niemann H. Xenotransplantation. 2009 Nov-Dec;16(6):522-34. doi: 10.1111/j.1399-3089.2009.00556.x.
NF kappaB activation in embryonic endothelial progenitor cells enhances neovascularization via PSGL-1 mediated recruitment: novel role for LL37. Pfosser A, El-Aouni C, Pfisterer I, Dietz M, Globisch F, Stachel G, Trenkwalder T, Pinkenburg O, Horstkotte J, Hinkel R, Sperandio M, Hatzopoulos AK, Boekstegers P, Bals R, Kupatt C. Stem Cells. 2010 Feb;28(2):376-85. doi: 10.1002/stem.280.
- European Research Council
HORIZON-2020 Excellent Science/ ERC-2020-AdG: Cor-Edit-P (Cardiac open reading frame edition to study cardiomyopathies in pigs), ID: 101021043
HORIZON-HLTH-2022-DISEASE-06-two-stage/ grant: GEREMY (Gene Therapy for treatment of rare inherited Arrhythmogenic CardioMyopathy), ID: 101080204
- Deutsche Forschungsgemeinschaft (DFG)
SFB TRR 127: Xenotransplantation (local immunomodulation by viral vectors and genetic modifications)
SFB TRR 267: non-coding RNA in cardiovascular systems (in vivo manipulation of non-coding RNAs in pig hearts
- Deutsches Zentrum für Herz-/Kreislaufforschung, Munich Heart Alliance
Standortprojekt: Large animal models, FKZ 81Z0600602
Translationales Forschungsprojekt: rAAV-MRTF-A-based vascular gene therapy in chronic hindlimb ischemia (GeneVaPad), FKZ 81X2600628
- Else-Kröner-Fresenius Stiftung
Projekt: Refined locoregional genome editing to treat Duchenne muscular dystrophy, FKZ: 2022_EKSE.41
- DLR Projektträger
Peptidstudie in Kooperation mit der Universität Heidelberg: S100A1ct Peptidtherapie der dekompensierten Herzmuskel-schwäche mit reduzierter Ejektionsfraktion (HFrEF), FKZ 01KC2008B
- Auftragsforschung




