(English: Regenerative Medicine of Cardiovascular Diseases)
Jüngste Fortschritte in der Entwicklungs- und Stammzellbiologie haben den Weg für ein breites Spektrum neuartiger kardiovaskulärer Therapien geebnet, von der Transplantation von aus Stammzellen gewonnenen Zellen bis hin zur Stimulierung körpereigener Regenerationsprozesse. Es sind jedoch noch viele grundlegende wissenschaftliche Fragen zu beantworten, bevor diese Konzepte erfolgreich in die Behandlung von Patienten umgesetzt werden können. Die Beantwortung solcher Fragen mit State-of-the-art Methoden ist das übergreifende Ziel unserer Arbeitsgruppe.
In den nachfolgend beschriebenen Forschungsprojekten kombinieren wir 2D- und 3D-In-vitro-Modelle, die auf menschlichen pluripotenten Stammzellen basieren, mit Tiermodellen wie der Maus und dem Schwein. Ein weiterer wichtiger Aspekt unserer Arbeit ist der Einsatz von CRISPR/Cas9-Gen-Editierung für viele Anwendungen, einschließlich der Erzeugung von Reporterzelllinien und der Entwicklung neuer Gentherapieansätze.
Kardiale Entwicklungsbiologie
Das Herz ist das erste Organ, das sich bildet, und weist eine komplexe Struktur auf, die aus vielen spezialisierten Zelltypen besteht (z. B. Herzmuskelzellen, Zellen der Blutgefäße und Bindegewebszellen). Während der Entwicklung müssen sich Zellen schnell vermehren, aber auch spezifizieren, d. h. ihr Entwicklungspotenzial begrenzen und festlegen, in welchen Zelltyp sie sich später differenzieren werden. Unsere Forschungsgruppe untersucht, wie verschiedene kardiovaskuläre Vorläuferpopulationen entstehen, sich spezifizieren und differenzieren. Dies verfolgen wir insbesondere durch die Rekonstruktion von Abstammungslinien mittels Einzelzell-Transkriptomik und der Analyse von Chromatinzugänglichkeit. Wir sind außerdem daran interessiert, wie diese Prozesse bei angeborenen Herzfehlern gestört werden und wie wir das Wissen aus der Entwicklung nutzen können, um neue regenerative Ansätze für Erwachsene zu entwickeln.
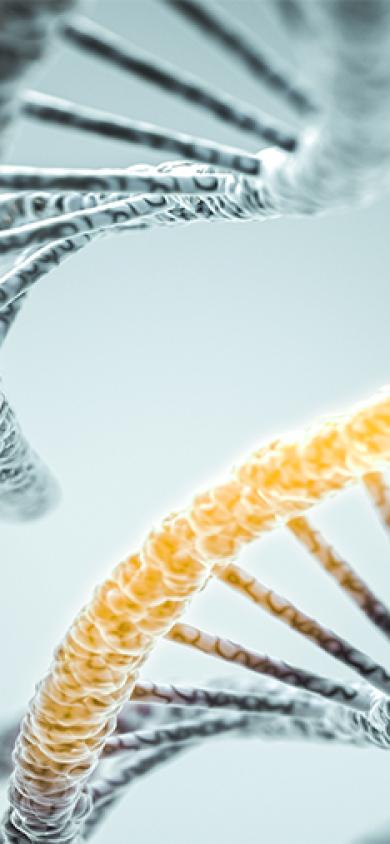
Eines unserer Interessensgebiete ist die Funktion von frühen kardialen Transkriptionsfaktoren wie Isl1. Jener wird in kardiovaskulären Vorläuferzellen des sogenannten zweiten Herzfeldes (SHF) exprimiert, die später hauptsächlich zur Bildung der rechten Herzkammer, des Ausflusstraktes und Teilen der Vorhöfe beitragen.
links: Whole-mount immunhistologische Färbung eines Isl1Cre/+;R26mTmG/+-Embryos am Embryonaltag 9,5. Sie zeigt die Isl1-Cre-vermittelte mG-Markierung (grün) von Vorläufern des SHF und ihrer Derivate.
rechts: Immunohistological staining of a heart section from an Isl1Cre/+;R26mTmG/+ mouse at 4 weeks, showing Isl1-Cre mediated mG (green) marking of the right ventricle, parts of the left ventricle and both atria. Perilipin1 (magenta) marks adipocytes.
Krankheitsmodellierung mit humanen induzierten pluripotenten Stammzellen
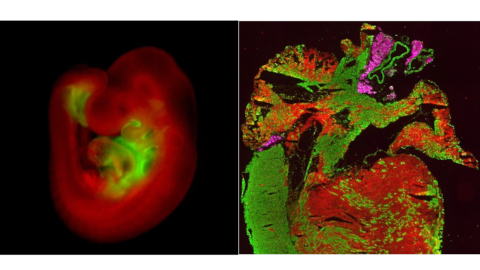
Humane induzierte pluripotente Stammzellen (hiPSCs) sind Stammzellen, die aus somatischen Zellen (z. B. Blut- oder Hautzellen) von gesunden Personen oder Patienten gewonnen werden. Sie haben die Fähigkeit, sich unbegrenzt zu erneuern und in vitro jeden Zelltyp des Körpers hervorzubringen, was sie zu einem außerordentlich leistungsfähigen Instrument für die Untersuchung menschlicher Krankheiten auf patientenspezifischem Hintergrund macht. Ein Schwerpunkt unserer Forschung ist der Einsatz von hiPSC-basierten Krankheitsmodellen zur Gewinnung von Einblicken in die molekularen und zellulären Mechanismen, die zu Herz-Kreislauf-Erkrankungen wie der arrhythmogenen rechtsventrikulären Kardiomyopathie (ARVC), dem hypoplastischen Linksherzsyndrom (HLHS), der mit dem Noonan-Syndrom assoziierten Kardiomyopathie, der linksventrikulären Non-compaction (LVNC) und anderen führen. Wenn ein therapeutisches Ziel identifiziert ist, verwenden wir hiPSC-Zellen auch als Plattform für die Erprobung neuer Therapien, wie wir dies bereits bei der Duchenne-Muskeldystrophie (DMD) angewandt haben.
links: Konfokales Immunfluoreszenzbild von hiPSC-abgeleiteten Kardiomyozyten, gefärbt für die Sarkomerproteine cardiac troponin T (rot) und a-actinin (grün). Skalenbalken: 50 µm.
rechts: Live-Immunfluoreszenzbild eines 3D-Herzsphäroids, das aus einer Doppelreporter-Stammzelllinie stammt, die eGFP und mCherry in den endogenen Loci der kardialen Transkriptionsfaktoren NKX2.5 bzw. TBX5 exprimiert. Skalenbalken: 200 µm.
3D-Herzgewebemodelle
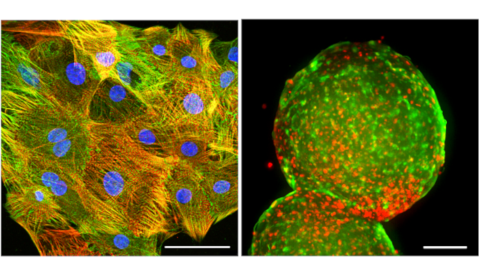
Da Zellen, die in 2D kultiviert werden, bestimmte Eigenschaften ihrer in vivo-Gegenstücke nicht nachbilden können, ist ein Teil unserer Arbeit der Entwicklung von 3D-Herzmodellen gewidmet, die die Physiologie des Herzgewebes besser nachahmen. Wir stellen routinemäßig künstliches Herzgewebe auf der Grundlage von hiPSC-Herzzellen her, die auf dezellularisierte ventrikuläre Matrix von Schweinen oder nichtmenschlichen Primaten ausgesät wurden. Diese Konstrukte kultivieren wir in einem biomimetischen Kammersystem, das die Gewebereifung durch kontinuierliche mechanische und elektrische Stimulation fördert. Wir haben auch ein Ex-vivo-Embryo-Kultursystem entwickelt, mit dem wir die Funktion menschlicher Herzzellen in Mensch-Maus- oder Mensch-Schwein-Chimären untersuchen können. Schließlich haben wir vor kurzem aus menschlichen pluripotenten Stammzellen abgeleitete Herzorganoide erzeugt, die eine morphologische, funktionelle und molekulare Selbstorganisation des ventrikulären Myokards und Epikards aufweisen.
links: Konfokales Immunfluoreszenzbild eines kardialen Organoidschnitts, das die äußere Epikardschicht (tight junction protein 1 Färbung in gelb), die darunter liegenden EPDCs, die eine epithelial-mesenchymale Transition durchlaufen haben (Vimentin Färbung in magenta), und die Myokardschicht (cardiac troponin T Färbung in grün) zeigt. Skalenbalken: 50 µm.
rechts: Biomimetische Kammer mit künstlichem Herzgewebe, das einer Hochfrequenzablation unterzogen wird, um eine akute Herzmuskelverletzung zu simulieren.
Methodenspektrum
- Erzeugung, Kultivierung und Differenzierung humaner pluripotenter Stammzellen in 2D und 3D
- CRISPR/Cas9 Gen-Editierung für die Erzeugung von Reporterlinien und Knock-in/Knock-out-Linien
- Funktionelle Charakterisierung von Kardiomyozyten durch Kalzium-Imaging, optische Ableitungen des Aktionspotenzials und Kontraktilitätsmessungen
- Bulk- und single-cell-RNA-sequencing und ATAC-sequencing
- Immunofluoreszenzanalyse, konfokale Mikroskopie
- Durchflusszytometrie und FACS sorting
- Zellinjektion in Embryonen und ex vivo Embryokultivierung
- Molekularbiologische Techniken einschließlich Klonierung, digitale PCR
- Kapillarer Western Blot, Chromatin-Immunpräzipitation
Team
- Prof. Dr. Alessandra Moretti
Chair of Regenerative Medicine of Cardiovascular Diseases, group leader - Dr. Tatjana Dorn
Senior scientist (developmental biology, lineage decision) - Dr. Monika Nowak-Imialek
Veterinarian scientist (porcine expanded pluripotent stem cells & human-pig chimeras) - Dr. Gianluca Santamaria
Postdoc (bioinformatic data analysis) - Dr. Alexander Göedel
Physician scientist (bioinformatic data analysis) - Dr. Christine Schneider
Physician scientist (3D tissue engineering & functional imaging) - Sophie Zengerle
PhD student (organoids and modeling of congenital heart disease) - Sinem Sürmeli
PhD student (CRISPR-based genome editing) - Luis Felipe Monge Mora
PhD student (cardiac organiods and imaging) - Marco Crovella
Technician (animals and histology) - Christina Scherb
Technician (molecular biology) - Birgit Campbell
Technician (cell culture and iPSC generation) - Aylin Mayer
Technician (heart tissue slices and gene editing)
Ausgewählte Publikationen
Originalarbeiten
Rawat H, Kornherr J, Zawada D, Bakhshiyeva S, Kupatt C, Laugwitz KL, Bähr A, Dorn T, Moretti A, Nowak-Imialek M. (2023) Recapitulating porcine cardiac development in vitro: from expanded potential stem cell to embryo culture models. Front Cell Dev Biol. 11:1111684. doi: 10.3389/fcell.2023.1111684. PMID: 37261075
Poch CM, Dendorfer A, Laugwitz KL, Moretti A. (2023) Ex vivo Culture and Contractile Force Measurements of Non-human Primate Heart Slices. Bio Protoc. 13(13):e4750. doi: 10.21769/BioProtoc.4750. PMID: 37456341
Meier AB, Zawada D, De Angelis MT, Martens LD, Santamaria G, Zengerle S, Nowak-Imialek M, Kornherr J, Zhang F, Tian Q, Wolf CM, Kupatt C, Sahara M, Lipp P, Theis FJ, Gagneur J, Goedel A, Laugwitz KL, Dorn T, Moretti A. (2023) Epicardioid single-cell genomics uncovers principles of human epicardium biology in heart development and disease. Nat Biotechnol. 41(12):1787-1800. doi: 10.1038/s41587-023-01718-7. PMID: 37012447
Zawada D, Kornherr J, Meier AB, Santamaria G, Dorn T, Nowak-Imialek M, Ortmann D, Zhang F, Lachmann M, Dreßen M, Ortiz M, Mascetti VL, Harmer SC, Nobles M, Tinker A, De Angelis MT, Pedersen RA, Grote P, Laugwitz KL, Moretti A, Goedel A. (2023) Retinoic acid signaling modulation guides in vitro specification of human heart field-specific progenitor pools. Nat Commun. 14(1):1722. doi: 10.1038/s41467-023-36764-x. PMID: 37012244
Poch CM, Foo KS, De Angelis MT, Jennbacken K, Santamaria G, Bähr A, Wang QD, Reiter F, Hornaschewitz N, Zawada D, Bozoglu T, My I, Meier A, Dorn T, Hege S, Lehtinen ML, Tsoi YL, Hovdal D, Hyllner J, Schwarz S, Sudhop S, Jurisch V, Sini M, Fellows MD, Cummings M, Clarke J, Baptista R, Eroglu E, Wolf E, Klymiuk N, Lu K, Tomasi R, Dendorfer A, Gaspari M, Parrotta E, Cuda G, Krane M, Sinnecker D, Hoppmann P, Kupatt C, Fritsche-Danielson R, Moretti A, Chien KR, Laugwitz KL. (2022) Migratory and anti-fibrotic programmes define the regenerative potential of human cardiac progenitors. Nat Cell Biol. 24(5):659-671. doi: 10.1038/s41556-022-00899-8. PMID: 35550611
Esfandyari D, Idrissou BMG, Hennis K, Avramopoulos P, Dueck A, El-Battrawy I, Grüter L, Meier MA, Näger AC, Ramanujam D, Dorn T, Meitinger T, Hagl C, Milting H, Borggrefe M, Fenske S, Biel M, Dendorfer A, Sassi Y, Moretti A, Engelhardt S. (2022) MicroRNA-365 regulates human cardiac action potential duration. Nat Commun. 13(1):220. doi: 10.1038/s41467-021-27856-7. PMID: 35017523
Krane M, Dreßen M, Santamaria G, My I, Schneider CM, Dorn T, Laue S, Mastantuono E, Berutti R, Rawat H, Gilsbach R, Schneider P, Lahm H, Schwarz S, Doppler SA, Paige S, Puluca N, Doll S, Neb I, Brade T, Zhang Z, Abou-Ajram C, Northoff B, Holdt LM, Sudhop S, Sahara M, Goedel A, Dendorfer A, Tjong FVY, Rijlaarsdam ME, Cleuziou J, Lang N, Kupatt C, Bezzina C, Lange R, Bowles NE, Mann M, Gelb BD, Crotti L, Hein L, Meitinger T, Wu S, Sinnecker D, Gruber PJ, Laugwitz KL, Moretti A. (2021) Sequential Defects in Cardiac Lineage Commitment and Maturation Cause Hypoplastic Left Heart Syndrome. Circulation. 144(17):1409-1428. doi: 10.1161/CIRCULATIONAHA.121.056198. PMID: 34694888
Moretti A, Fonteyne L, Giesert F, Hoppmann P, Meier AB, Bozoglu T, Baehr A, Schneider CM, Sinnecker D, Klett K, Fröhlich T, Rahman FA, Haufe T, Sun S, Jurisch V, Kessler B, Hinkel R, Dirschinger R, Martens E, Jilek C, Graf A, Krebs S, Santamaria G, Kurome M, Zakhartchenko V, Campbell B, Voelse K, Wolf A, Ziegler T, Reichert S, Lee S, Flenkenthaler F, Dorn T, Jeremias I, Blum H, Dendorfer A, Schnieke A, Krause S, Walter MC, Klymiuk N, Laugwitz KL, Wolf E, Wurst W, Kupatt C (2020). Somatic gene editing ameliorates skeletal and cardiac muscle failure in pig and human models of Duchenne muscular dystrophy. Nat Med 26(2):207-214
Guo Y, Dorn T, Kühl SJ, Linnemann A, Rothe M, Pfister AS, Vainio S, Laugwitz KL, Moretti A*, Kühl M* (2019). The Wnt inhibitor Dkk1 is required for maintaining the normal cardiac differentiation program in Xenopus laevis. Dev Biol. 449:1-13.
Dorn T, Kornherr J, Parrotta EI, Zawada D, Ayetey H, Santamaria G, Iop L, Mastantuono E, Sinnecker D, Goedel A, Dirschinger RJ, My I, Laue S, Bozoglu T, Baarlink C, Ziegler T, Graf E, Hinkel R, Cuda G, Kääb S, Grace AA, Grosse R, Kupatt C, Meitinger T, Smith AG, Laugwitz KL, Moretti A. (2018) Interplay of cell-cell contacts and RhoA/MRTF-A signaling regulates cardiomyocyte identity. EMBO J 37:pii: e98133.
Chen Z, Xian W, Bellin M, Dorn T, Tian Q, Goedel A, Dreizehnter L, Schneider CM, Ward-van Oostwaard D, Ng JK, Hinkel R, Pane LS, Mummery CL, Lipp P, Moretti A, Laugwitz KL, Sinnecker D. (2017) Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. Eur Heart J 38:292-301.
Rocchetti M, Sala L, Dreizehnter L, Crotti L, Sinnecker D, Mura M, Pane LS, Altomare C, Torre E, Mostacciuolo G, Severi S, Porta A, De Ferrari GM, George AL Jr, Schwartz PJ, Gnecchi M, Moretti A, Zaza A. (2017) Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovasc Res 113:531-541.
Gramlich M, Pane LS, Zhou Q, Chen Z, Murgia M, Schötterl S, Goedel A, Metzger K, Brade T, Parrotta E, Schaller M, Gerull B, Thierfelder L, Aartsma-Rus A, Labeit S, Atherton JJ, McGaughran J, Harvey RP, Sinnecker D, Mann M, Laugwitz KL, Gawaz MP, Moretti A. (2015) Antisense-mediated exon skipping: a therapeutic strategy for titin-based dilated cardiomyopathy. EMBO Mol Med 7:562-76.
Dorn T, Goedel A, Lam JT, Haas J, Tian Q, Herrmann F, Bundschu K, Dobreva G, Schiemann M, Dirschinger R, Guo Y, Kühl SJ, Sinnecker D, Lipp P, Laugwitz KL, Kühl M, Moretti A. (2015). Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells 33(4):1113-29.
Jung CB, Moretti A, Schnitzler MM, Iop L, Storch U, Bellin M, Dorn T, Ruppenthal S, Pfeiffer S, Goedel A, Dirschinger RJ, Seyfarth M, Lam JT, Sinnecker D, Gudermann T, Lipp P & Laugwitz K-L (2012). Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Mol. Med. 3:180-191.
Moretti A, Bellin M, Welling A, Jung CB, Lam JT, Bott-Flügel L, Dorn T, Gödel A, Höhnke C, Hofmann F, Seyfarth M, Sinnecker D, Schömig A & Laugwitz K-L (2010). Patient-specific induced pluripotent stem cell models for long-QT syndrome. N. Engl. J. Med. 363: 1397-409.
Qyang Y, Martin-Puig S, Chiravuri M, Chen S, Xu H, Bu L, Jiang X, Lin L, Granger A, Moretti A, Caron L, Wu X, Clarke J, Taketo MM, Laugwitz K-L, Moon RT, Gruber P, Evans SM, Ding S & Chien KR (2007). The renewal and differentiation of Isl1+ cardiovascular progenitors are controlled by a Wnt/β-catenin pathway. Cell Stem Cell 1: 1-15.
Moretti A, Caron, L, Nakano, A, Lam, JT, Chen, Y, Qyang, Y, Sasaki, M, Yunfu, S, Evans, S, Laugwitz, K-L & Chien KR (2006). Multipotent embryonic isl1+ progenitor cells lead to cardiac, smooth muscle, and endothelial cell diversification. Cell 127: 1151-1166.
Laugwitz K-L, Moretti A, Lam J, Gruber P, Yinhong Chen, Woodard S, Lin L-Z, Cai C-L, Lu M, Reth M, Platoshyn O, Yuan J, Evans S & Chien KR (2005). Postnatal isl1+ cardioblasts enter fully differentiated cardiomyocyte lineages. Nature 433: 647-653.
Buchkapitel, Reviews und Editorials
Dirschinger R., Dorn T., Moretti A. (2019) Human Induced Pluripotent Stem Cells as Platform for Functional Examination of Cardiovascular Genetics in a Dish. In: Erdmann J., Moretti A. (eds) Genetic Causes of Cardiac Disease. Cardiac and Vascular Biology, vol 7. Springer, Cham
Sinnecker D, Moretti A. (2018) Induced Pluripotent Stem Cell-Derived Cardiomyocytes: Towards Personalized Therapeutic Strategies? In: Dierk Thomas, Carol Ann Remme (Eds.) Channelopathies in Heart Disease. Springer International Publishing, ISBN 978-3-319-77811-2.
Sinnecker D, Laugwitz KL, Moretti A. (2014) Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacol Ther 143:246-52.
Moretti A, Laugwitz KL, Dorn T, Sinnecker D, Mummery C. (2013) Pluripotent stem cell models of human heart disease. Cold Spring Harb Perspect Med 3. pii: a014027.
Evans SM, Moretti A & Laugwitz KL (2010). MicroRNAs in a cardiac loop: progenitor or myocyte? Dev. Cell 19: 787-8.
Laugwitz K-L, Moretti A, Nakano A & Chien KR (2008). Islet-1 Cardiovascular Progenitors: A single source for heart lineages? Development 135: 193-205.
Chien KR, Moretti A & Laugwitz K-L (2004). ES cells to the Rescue. Science 306: 239-240.
Wissenschaftliche Projekte & Drittmittelförderung
Wissenschaftliche Projekte:
Naturwissenschaftliche Diplom- und Doktorarbeiten sowie medizinische Doktorarbeiten auf Anfrage
Drittmittelförderung:
- European Research Council - EPICURE
- Deutsche Forschungsgemeinschaft
- Deutsches Zentrum für Herz-/Kreislaufforschung, Munich Heart
Alliance
- Else Kröner-Fresenius-Stiftung